轉自:轉自:生物谷 時間:2014-11-27 作者:生物觀察
2014歲末年終,是總結和反思的時候了,美國FDA和歐盟多個藥品監管機構,對中國很多制藥企業進行了各類檢查,有些中國制藥企業獲得了歐美藥品監管機構的認可。但是也同時有中國藥企被歐美藥品監管機構發現缺陷和警告,現在就來匯總看一下缺陷和問題究竟在哪里。
中國藥企缺陷問題匯總分析
在即將過去的2014年度,美國FDA和歐盟多個藥品監管機構,對中國很多制藥企業進行了各類檢查。這其中,有些中國制藥企業以扎實穩健的質量管理工作,獲得了歐美藥品監管機構的認可,為自己進軍國際市場奠定了扎實的基礎。同時,也有中國藥企,因為日常疏于管理,積累了很多痼疾,而被歐美藥品監管機構發現缺陷和警告。
歲末年終,應該是總結和反思的季節。筆者搜集信息和分析數據,希望將失敗者的教訓總結以分享各位制藥人,以期為制藥行業發展提供經驗和參考。
第一部分:FDA警告信(WL)揭示的缺陷分析
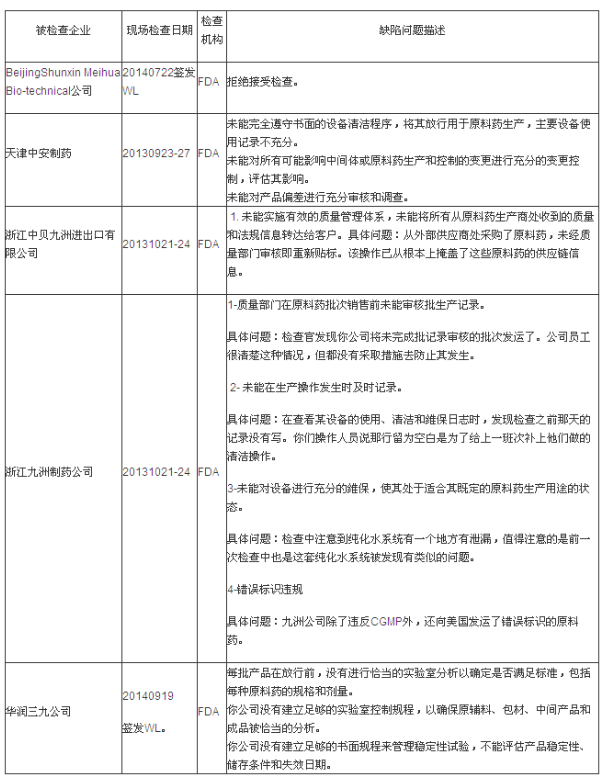
說明:有些企業是在2013年度被檢查的,但是警告信是2014年度簽發的,因此列入2014年度匯總分析表格中。本統計數據只包括中國大陸地區。
第二部分:EU GMP不符合報告揭示的缺陷分析
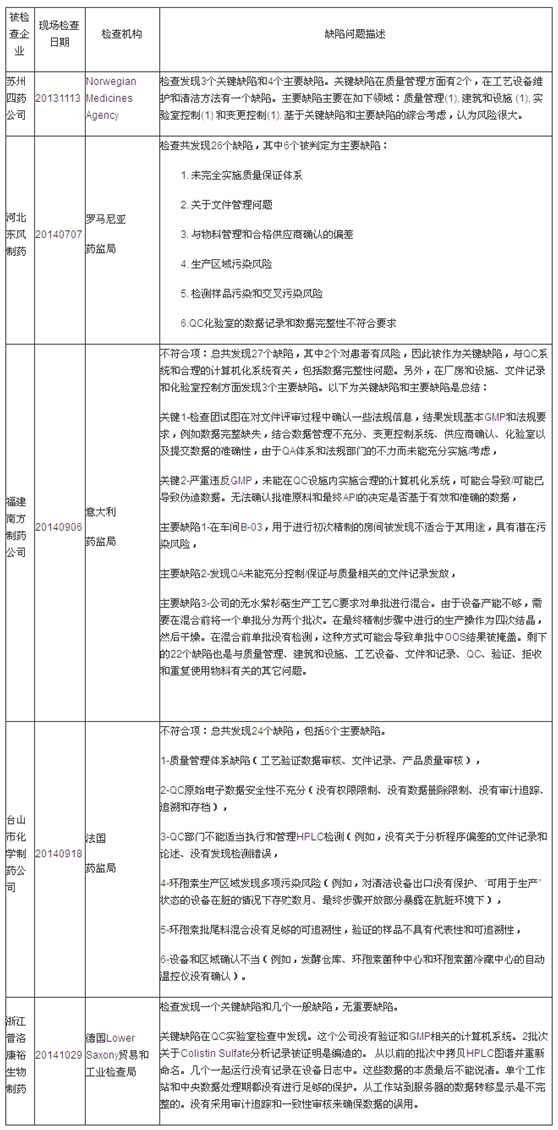
說明:有些企業是在2013年度被檢查的,但是GMP不符合報告是2014年度簽發的,因此列入2014年度匯總分析表格中。本統計數據只包括中國大陸地區。
匯總分析
從上述問題,可以看出中國制藥企業還有很多工作要做,還有很多需要完善的地方。綜合分析,可以看出中國制藥企業缺陷問題集中于如下領域:
第一、企業高層不重視,不能提供足夠資源。例如這句九洲被發現問題中就體現,質量部門明明知道質量管理的程序,但是由于人力資源不足,不能對產品質量進行足夠控制。
第二、計算機系統控制不足。隨著FDA不斷強化21CFR11法規,以及歐盟檢查團隊對計算機驗證要求的提高,以后這個問題也是被檢查的主要問題。
第三、數據不完整。這個問題既可能發生在QC領域,也可能發生在生產領域。需要中國制藥花費大力氣去整改。
第四、設備維護和清潔工作要持續關注。在歐盟GMP條款中,對于設備的預防性維護,要求是很高的。如果檢查組發現設備維護不利,很容易開始懷疑產品質量是否有把握。


